原标题:我科研团队揭示双功能分子协同P450酶催化系统的结构基础与过氧化物酶新功能
7月21日,记者从中国科学院青岛能源所获悉,该所单碳酶催化研究组与代谢物组学研究组冯银刚研究员团队合作,巧妙地利用羟胺代替过氧化氢,成功制备并解析了蛋白-羟胺-双功能小分子三元复合物的高分辨率晶体结构,建立了双功能小分子协同P450活化过氧化氢的预反应态模型,为解析其分子机制提供了结构基础(图1);进而与厦门大学王斌举教授团队合作,通过理论计算模拟,进一步阐明了双功能小分子介入活性中心氢键网络、使过氧化氢以较低能垒的异裂方式被活化,有利于反应活性物种生成,从而大幅提高了P450酶催化活力的反应机理。
细胞色素P450酶是一类含血红素的单加氧酶,在药物代谢、异生物质解毒和类固醇生物合成中发挥重要作用,同时因其具有多功能生物氧化催化、合成的应用潜力而备受关注。
针对绝大多数天然P450单加氧酶催化功能的实现高度依赖辅酶NAD(P)H和负责电子传递的还原伴侣蛋白的关键科学问题,中科院青岛能源所丛志奇研究员带领的单碳酶催化研究组成功构建了双功能小分子(DFSM)协同P450酶催化系统,能够有效利用过氧化氢作为末端氧化剂,解除P450酶对辅酶体系依赖的同时极大提高P450BM3对苯乙烯、乙苯、和苯甲硫醚等非天然底物的催化活性,为基于P450酶的生物催化剂开发提供了新的思路。
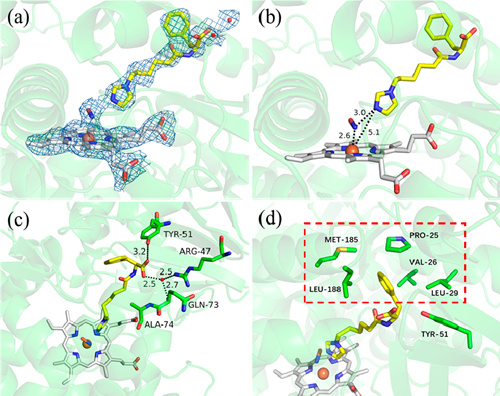
图1:“双功能分子-P450-羟胺”三元复合物的晶体结构 丛志奇 马娜娜 姜谊平 供图
近年来,该所单碳酶催化研究组先后报道了DFSM协同P450酶催化系统高效的过加氧酶(peroxygenase)功能,比如催化气态烷烃分子的选择羟化(ACS Catal. 2019, 9, 7350-7355)、木质素单体芳醚的脱甲基化(Catal. Sci. Technol. 2020, 10, 1219-1223. Inside front cover)、以及苯乙烯的高度R-对映选择性环氧化。为拓展DFSM协同P450酶系统的催化多功能性,研究人员利用酶化学机制指导的蛋白质工程策略将该系统由过加氧酶转换为过氧化物酶(peroxidase)模式,开发了DFSM协同P450酶催化系统的过氧化物酶新功能。
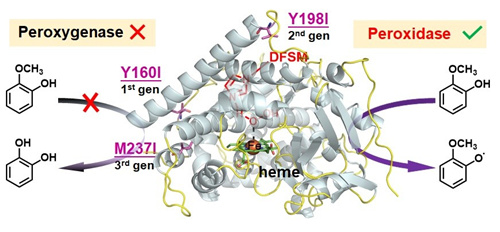
图2:DFSM促进的P450过加氧酶至过氧化物酶的功能转换 丛志奇 马娜娜 姜谊平 供图
过氧化物酶是一类重要的氧化还原酶,在生物催化、生物传感器和生物医学中具有广泛的应用。在细胞色素P450酶研究中,与单加氧酶和过加氧酶催化功能相比,对其过氧化物酶活性的研究仍然较少。研究人员基于对DFSM协同P450酶系统中三种可能催化途径的机制分析,提出了氧化还原敏感残基的竞争性氧化途径可能是阻碍该系统过氧化物酶功能的主要原因的假设,进而通过对不同种类氧化还原敏感残基进行热点筛选和迭代组合突变,成功开发出DFSM协同P450酶系统的过氧化物酶新功能(图2),能够高效催化愈创木酚、2,6-二甲氧基苯酚、邻苯二胺、对苯二胺的一电子氧化反应,催化性能可媲美或超过大多数天然过氧化物酶。与厦门大学王斌举教授团队的模拟计算合作研究表明,DFSM协同P450系统中过氧化物酶活性可能来源于消除氧化还原敏感残基的竞争性氧化或蛋白质工程后底物的重定位。该研究进一步证明了DFSM协同P450酶催化系统的可塑性和在生物催化领域的应用潜力,为发展基于P450酶的生物催化剂提供了新的见解和策略。
目前上述两项相关工作均发表于国际催化领域权威杂志ACS Catalysis《美国化学会催化杂志》。厦门大学张璇博士、中科院青岛能源所姜谊平博士、厦门大学陈倩倩为论文一的共同第一作者,厦门大学王斌举教授、中科院青岛能源所丛志奇研究员、冯银刚研究员为共同通讯作者;中科院青岛能源所博士研究生马娜娜和厦门大学房文涵为论文二的共同第一作者,丛志奇、王斌举教授为共同通讯作者。
科技日报记者 王健高 通讯员 刘佳
细胞色素
P450酶
结构基础
发现网登载此文出于传递更多信息之目的,并不意味赞同其观点或证实其描述。文章内容仅供参考,不构成投资建议。投资者据此操作,风险自担。违法、不良信息举报和纠错,及文章配图版权问题均请联系本网,我们将核实后即时删除。




