科技日报记者 吴长锋
记者从中国科学技术大学获悉,该校细胞动力学教育部重点实验室张凯铭团队合作者合作,解析出Lon蛋白酶的完整三维结构并揭示其底物识别与转移的分子机制,研究成果日前分别发表在期刊《生物化学杂志》和《科学进展》上。
中国科学技术大学供图
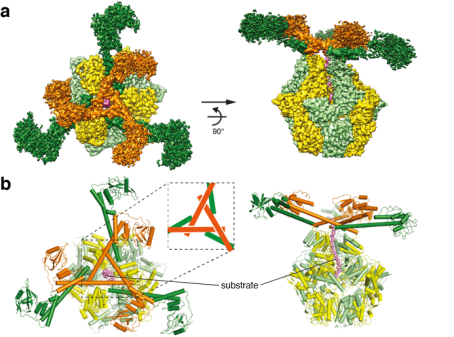
Lon AAA+蛋白酶(LonA)是一种在原核生物和真核生物细胞器中保守的ATP依赖性蛋白酶。LonA组装为同源六聚体,每个单体都包含一个N端结构域、一个中间ATP酶结构域和一个C端蛋白酶结构域。LonA通过降解受损或错误折叠的异常蛋白质在细胞蛋白质稳态中发挥重要作用,从而防止这些不需要的蛋白质种类形成有毒聚集体。LonA还通过降解特定的调节蛋白来调控多种生物过程。然而目前为止,Lon六聚体的现有报道的所有结构中没有包含N端区域,Lon如何选择蛋白质靶标作为底物、控制底物进入AAA+结构域、并介导底物去折叠的机制尚不清楚。
张凯铭课题组解析了Lon蛋白酶底物结合状态的冷冻电镜结构,发现ATPase结构域的双孔环介导底物相互作用,由处于不同ATP结合和水解状态的四个连续单体以螺旋梯状排列,揭示了其通过LonA特异性变构实现持续性旋转易位的分子机制。同时,这些结构显示了一个具有张拉整体三角形复合体的多层结构,独特地由六个长N端螺旋构成。相互锁定的螺旋三角形组装在六聚体核心的顶部,以展开一个由六个球状底物结合域组成的网。它作为一个多用途平台,控制底物进入AAA+环、提供基于标尺的底物选择机制、并充当滑轮装置以促进AAA+环将ATP驱动的构象变化转化为机械力来推动易位底物的展开。
该研究成果为理解Lon和其他具有类似活性的AAA+蛋白酶的结构机制提供了一个完整的框架。
Lon蛋白酶
三维结构
发现网登载此文出于传递更多信息之目的,并不意味赞同其观点或证实其描述。文章内容仅供参考,不构成投资建议。投资者据此操作,风险自担。违法、不良信息举报和纠错,及文章配图版权问题均请联系本网,我们将核实后即时删除。




